– 22 DÉCEMBRE 2016POSTED IN: INNOVATION
A la fin du mois de Septembre, le premier pancréas artificiel a été autorisé aux Etats-Unis par la FDA (Food and Drug Agency), l’agence américaine du médicament. Son nom est le MiniMed 670G, fabriqué par Medtronic dont le siège est en Irlande. Il est destiné aux personnes atteintes de diabète de type I, le diabète insulino-dépendant. Le pancréas artificiel (pour la partie endocrinienne) est le résultat de la combinaison de plusieurs dispositifs palliant les défaillances du pancréas, plus précisément la sécrétion de l’insuline (hormone hypoglycémiante).
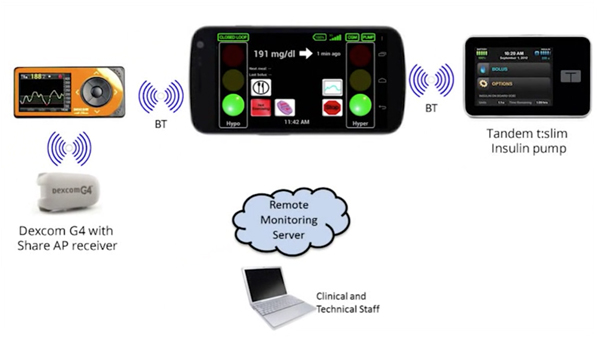
Son fonctionnement peut être résumé de cette façon : un système mesure la quantité de glucose dans le sang en continue. Un capteur sous-cutané mesure la glycémie toutes les 5 minutes → un logiciel sur smartphone ou un boitier spécial calcule la quantité d’insuline nécessaire pour normaliser la glycémie → une pompe à insuline reçoit ces informations et délivre une quantité d’insuline en fonction des résultats obtenus. Votre smartphone ou le boitier affiche le niveau de glycémie et d’insuline.
Le système est hybride. C’est-à-dire qu’il est totalement autonome pour les périodes sans facteurs modifiants la glycémie (la nuit par exemple). Cependant lors des repas, le patient doit au préalable informer le système sur ce qu’il va ingérer afin que le pancréas artificiel s’adapte à cette perturbation. Il est donc nécessaire que le patient se forme à l’utilisation de l’appareil. Sa commercialisation est prévue en 2017 aux Etats-Unis. Ce dispositif révolutionnaire apporte aux patients atteints de diabète de type I une plus grande liberté, moins d’hypoglycémies et un meilleur équilibre du diabète.
Il ne sera plus nécessaire de contrôler constamment et manuellement ni leur glycémie ni l’injection de l’insuline. Le dispositif présente des contre-indications : il est déconseillé aux patients ayant besoin de moins de 8 unités par jour et aux enfants de 6 ans ou moins. Le système n’a pas encore l’accord européen. Les données scientifiques ne se résument qu’à une seule étude sur 3 mois En France, trois grands groupes sont en lice pour l’accord de commercialisation : Medtronic, Bigfoot et la société française Diabeloop.
Vidéo explicative du fonctionnement : www.lequotidiendumedecin.fr
Source : le quotidien du Médecin, n°9564, 11/2016
ALEXANDRE JOOS
ERGOTHERAPEUTE
ERGOTHERAPEUTE


Commentaires
Enregistrer un commentaire